Imunitas adaptif adalah respon pertahanan tubuh melawan infeksi yang spesifik (antigen). Imunitas adaptif membutuhkan waktu untuk berkembang namun spesifisitasnya sangatlah tinggi. Imunitas adaptif juga memiliki kekhasan, yaitu immunological memory, atau ingatan imunologis, dimana kalau tubuh seseorang sudah pernah terpapar oleh sebuah agen infeksius, maka kalau ia terpapar lagi untuk kedua kali dan seterusnya, responnya akan lebih kuat dari sebelumnya.

Beberapa prinsip yang berlaku dalam imunitas adaptif adalah sebagai berikut:
1. Interaksi antigen dengan reseptornya menyebabkan limfosit mendapatkan fungsi efektor dan memori
Sistem imun adaptif berlangsung terutama akibat peranan limfosit. Limfosit merupakan jenis leukosit yang bentuknya kecil, organel sitoplasmanya sedikit, namun kromatin intinya padat. Penampakannya sebagai berikut:

Pada saat inaktif, limfosit bisa dibilang sedikit sekali fungsinya. Limfosit hanya akan aktif kalau sudah ada antigen spesifik yang berikatan pada reseptor antigen yang ada di permukaan selnya. Limfosit yang belum diaktivasi oleh antigen disebut limfosit naif, sementara yang sudah diaktivasi akan berdiferensiasi menjadi limfosit fungsional yang disebut limfosit efektor.
Jenis limfosit ada dua macam, yakni limfosit B (Sel B) dan limfosit T (Sel T). Sel B dan Sel T dibedakan berdasarkan struktur reseptor antigen yang mereka ekspresikan di permukaan selnya. Reseptor antigen pada Sel B atau Reseptor Sel B (BCR) dibentuk oleh gen yang sama dengan gen yang membentuk reseptor antibodi, yaitu sebuah kelas protein yang disebut immunoglobulin (Ig). Oleh sebab itu, reseptor sel B juga disebut immunoglobulin membran (mIg) atau immunoglobulin permukaan (sIg). Sementara itu, reseptor antigen pada Sel T atau Reseptor Sel T (TCR), berhubungan juga dengan immunoglobulin tapi struktur dan sifat-sifat pengenalnya berbeda.
Apabila ada suatu antigen yang berikatan dengan reseptor sel B, maka Sel B itu akan beproliferasi dan berdiferensiasi menjadi Sel Plasma. Sel plasma ini merupakan bentuk efektor dari sel B, dan mereka bisa melepaskan reseptornya dalam bentuk antibodi yang strukturnya persis sama dengan struktur reseptor sel B itu sendiri. Antibodi inilah yang akan bertindak dan menargetkan kerjanya pada antigen yang mengaktivasi sel B menjadi sel plasma tadi.
Sementara itu kalau pada sel T, apabila sebuah antigen telah berikatan dengan reseptornya, sel T tersebut akan berdiferensiasi menjadi bentuk fungsional lain yang disebut limfosit T efektor. Berdasarkan aktifitasnya, sel T efektor ini terbagi menjadi tiga kelas, yaitu Sel T Sitotoksik, Sel T Helper, dan Sel T Regulator. Sel T Sitotoksik berfungsi membunuh sel-sel lain yang terinfeksi oleh patogen yang memiliki antigen tersebut. Sel T helper lebih kepada menyediakan sinyal, terutama untuk merangsang sel B menghasilkan antibodi dan memperkuat makrofag untuk membunuh patogen yang dimakannya. Sedangkan Sel T regulator berfungsi untuk meredam aktifitas limfosit-limfosit lainnya agar tidak terjadi kerusakan yang berlebihan akibat respon imun yang sedang berlangsung.
Namun, beberapa sel B dan sel T yang diaktivasi oleh antigen dapat pula berdiferensiasi menjadi sel memori, yaitu limfosit yang dapat mempertahankan imunitas terhadap antigen yang sama dalam jangka waktu yang panjang, sehingga dapat dimanfaatkan dalam prosedur vaksinasi. Sel memori ini akan siap sedia berdiferensiasi menjadi sel-sel efektor kalau tubuh terpapar oleh antigen yang sama untuk kedua kalinya.
2. Antibodi dan reseptor sel T terdiri dari regio konstan dan regio variabel yang memiliki fungsi berbeda
Molekul antibodi terdiri dari dua regio yang berbeda, yakni regio konstan atau fragment crystallizable region (Regio Fc) dan regio variabel. Regio Fc hanya terdiri dari empat bentuk yang berbeda, sementara region variabel dapat memiliki bentuk yang sangat kaya dan beranekaragam, terdiri dari sekuens asam-asam amino yang memungkinkan antibodi tersebut mengenali banyaknya jenis antigen. Struktur antibodi ini ditemukan pada tahun 1972 oleh Gerald Edelman dan Rodney Porter melalui serangkaian percobaan menggunakann kristalografi sinar X.
Molekul antibodi juga terdiri dari dua rantai berat yang identik dan dua rantai ringan yang identik pula. Rantai ringan dan berat ini masing-masing memiliki regio konstan dan regio variabel. Regio variabel pada rantai berat dan ringan bergabung membentuk antigen-binding site yang menentukan spesifisitas dari ikatan antigen pada antibodi tersebut. Karena antibodi memiliki dua regio variabel yang identik, maka antigen-binding site-nya juga ada dua. Sementara itu regio konstanlah yang menentukan fungsi efektor dari antibodi, yakni bagaimana antibodi tersebut akan berinteraksi dengan sel-sel imun lainnya untuk melawan antigen ia bawa. Struktur antibodi dapat dilihat di bawah ini:

Sementara itu reseptor sel T juga punya kemiripan dengan reseptor sel B dan antibodi. Reseptor ini memiliki dua rantai utama, yakni α dan β, yang keduanya mempunya ukuran yang sama. TCR juga punya regio variabel dan regio konstan, serta kombinasi dari rantai α dan β pada regio variabelnya membentu satu antigen-binding site. Strukturnya dapat dilihat pada gambar berikut:

3. Antibodi dan reseptor sel T mengenali antigen dengan mekanisme yang berbeda

Pada dasarnya, hampir semua jenis struktur kimia dapat dianggap sebagai antigen oleh sistem imun adaptif, tapi yang paling banyak ditemui pada infeksi adalah protein, glikoprotein, dan polisakarida dari patogen.
Reseptor antibodi seseorang dapat mengidentifikasi sebuah antigen cukup dengan mengenali sedikit fragmen dari struktur molekul antigen tersebut yakni sebuah bagian dari antigen yang disebut antigenic determinant atau epitop. Antibodi dan reseptor sel B dapat langsung mengenali epitop dari antigen murni di dalam serum atau ruang ekstraseluler. Bisa saja sebuah antigen dapat dikenali oleh bermacam-macam jenis antibodi melalui epitop yang berbeda-beda pula.
Begitu juga dengan reseptor sel T, ia juga dapat mengenali antigen dengan cara yang tak jauh berbeda dengan antibodi. Reseptor sel T dapat mengenali epitop berbentuk peptida yang diperoleh dari degradasi protein, tapi hanya jika peptida tersebut bergabung dengan sebuah glikopretin di permukaan sel yang disebut molekul MHC. Glikoprotein permukaan sel ini dikode oleh sekelompok gen yang disebut major histocompatibility complex (MHC). Antigen yang dikenali oleh sel T dapat berasal dari patogen intraseluler seperti virus, atau dari ekstraseluler.

Perbedaan utama antara reseptor sel T dengan sel B adalah bahwasanya tidak ada reseptor sel T yang dilepaskan sebagaimana antibodi dilepaskan dari sel B, dan fungsi reseptor sel T hanyalah sebagai pemberi sinyal pada diri sel T untuk melakukan efek imunologisnya sesuai jenis masing-masing.
4. Gen reseptor antigen disusun oleh segmen-segmen gen reseptor yang inkomplit
Reseptor antigen spesifik pada imunitas adaptif memiliki spesifisitas yang hampir tidak terbatas namun justru dikode oleh gen-gen yang terbatas. Prinsip ini ditemukan oleh Susumu Tonegawa tahun 1976. Sekelompok segmen gen akan mengode regio variabel imunoglobulin. Segmen-segmen gen ini terbentuk melalui proses rekombinasi DNA ketika sel B mengalami perkembangan di sumsum tulang. Proses yang serupa juga terjadi pada sel T pada saat berkembang di timus saat membentuk gen-gen reseptornya.
Beberapa ratus segmen gen dapat bergabung membentuk ribuan rantai reseptor yang berbeda. Proses ini dikenal degan istilah combinatorial diversity, yang mampu menghasilkan resptor-reseptor yang sangat beragam. Lebih detail lagi, penambahan atau pemindahan nukleotida juga akan menghasilkan aneka ragam segmen-segmen gen. Keanekaragaman gen ini dikenal dengan istilah junctional diversity.
5. Limfosit yang teraktivasi oleh antigen akan memperbanyak diri dan memediasi imunitas adaptif
Ada dua hal terkait perkembangan limfosit yang membedakan imunitas adaptif dengan imunitas alamiah. Pertama, limfosit hanya akan mengekspresikan satu macam reseptor spesifik dan diperbanyak dengan kloning, sehingga reseptor pada satu limfosit matur akan berbeda dengan limfosit matur yang lainnya. Sementara pada imunitas alamiah, semua sel-sel yang terlibat di dalamnya mampu mengekspresikan reseptor yang bermacam-macam untuk banyak patogen. Kedua, karena penyusunan gen pada DNA limfosit bersifat ireversibel, semua turunannya akan menwariskan spesifitas reseptor yang sama.

Prinsip utama pewarisan sifat pada turunan limfosit dikenal dengan istilah clonal expansion. Antigen yang berikatan dengan reseptornya di limfosit akan mengaktivasi sel tersebut dan membuatnya membelah diri membentuk banyak turunan yang identik yang mampu mensekresikan antibodi klonotopik dengan spesifisitas yang sama persis. Teori ini disebut teori clonal selection dan ditemukan oleh Macfarlane Burnet tahun 1950 dengan empat postulat dasar, yaitu:
- Setiap limfosit memiliki satu tipe reseptor dengan spesifisitas yang unik.
- Interaksi yang kuat antara molekul asing dengan reseptor limfosit akan mengaktivasi limfosit.
- Sel-sel efektor yang lahir dari aktivasi limfosit memiliki reseptor yang persis sama dengan sel induknya yang aktif pertama kali.
- Limfosit yang memilki reseptor yang dapat berikatan dengan molekul dari diri sendiri akan disingkirkan di awal perkembangan.
6. Limfosit dengan reseptor yang self-reactive akan disingkirkan diwaktu perkembangan atau diinaktivasi secara fungsional
Limfosit pada umumnya tidak akan bereaksi terhadap antigen yang berasal dari diri sendiri karena memiliki sifat toleran. Hal ini dijelaskan oleh Ray Owen pada tahun 1940 melalui pengamatan pada anak sapi kembar dengan plasenta yang sama. Selain itu Peter Medawar tahun 1953 menjelaskan bahwa paparan jaringan asing selama perkembangan embrionik dapat membuat mencit menjadi toleran terhadap jaringan ini.
Namun, banyaknya jenis reseptor antigen yang terbentuk selama kehidupan seorang individu memungkinkan sebagian dari mereka bereaksi terhadap antigen dari dirinya sendiri. Rupanya, bagi limfosit yang berpotensi reaktif terhadap diri sendiri ternyata akan disingkirkan dulu sebelum matang. Proses ini disebut clonal deletion dan berhasil dijelaskan oleh Burnet dan Medawar pada tahun 1080. Limfosit yang menerima sinyal terlalu banyak dan terlalu sedikit melalui reseptor antigennya selama masa perkembangan, mereka akan dieliminasi melalui proses apoptosis (bunuh diri secara terprogram).
7. Limfosit menjadi matang di sumsum tulang atau timus dan berkumpul di jaringan limfoid
Limfosit yang beredar di darah dan limfe juga ditemukan dalam jumlah besar di jaringan limfoid atau organ limfoid. Mereka beragregasi di sana bersama-sama dengan sel-sel non limfoid. Organ limfoid dapat dibagi secara garis besar menjadi organ limfoid sentral (primer) dan organ limfoid perifer (sekunder). Organ limfoid sentral adalah sumsum tulang dan timus, sementara organ limfoid perifer meliputi kelenjar getah bening (nodus limfe), limpa, jaringan limfoid mukosa di usus, saluran pernafasan, saluran urogenital, dan mukosa lainnya.
Limfosit progenitor yang menjadi limfosit B dan limfosit T semuanya berasal dari sumsum tulang. Sel B akan tetap berkembang di sana hingga sempurna sementara prekusor sel T nantinya akan bermigrasi ke timus untuk menyempurnakan perkembangannya. Saat keduanya telah matang, kedua limfosit ini kemudian akan masuk ke sirkulasi darah sebagai limfosit naif dan terus beredar melalui jaringan limfoid perifer untuk menerima respon imun adaptif.

8. Respon imun adaptif dicetuskan oleh antigen dan antigen-presenting cells di jaringan limfoid sekunder
Respon imun adaptif dimulai ketika limfosit B atau T terpapar oleh antigen di reseptornya dan didukung oleh sinyal-sinyal peradangan. Pada sel T, aktivasi ini terjadi melalui pengenalan antigen yang dibawa oleh sel dendritik dari pusat infeksi ke organ limfoid sekunder. Aktivasi reseptor (PRR) sel-sel dendritik oleh molekul antigen (PAMPS) pada pusat infeksi akan menstimulasi sel tersebut untuk menelan patogen baik secara fagositosis atau pinositosis dan menghancurkannya di dalam sel.
Selanjutnya, peptida antigen tersebut akan ditampilkan pada molekul MHC dan dipaparkan pada reseptor antigen limfosit sehingga limfosit menjadi aktif. Aktivasi PRR ini juga akan memicu sel dendritik untuk mengekspresikan protein permukaan yang disebut molekul kostimulator, yang akan membantu limfosit T untuk berproliferasi dan berdiferensiasi menjadi bentuk fungsionalnya. Oleh sebab itu, sel-sel dendritik ini juga disebut antigen-presenting cells (APCs), dan menjadi penghubung yang krusial antara respon imun alamiah dengan respon imun adaptif.

Pada situasi tertentu, makrofag dan sel B juga dapat menjadi APC, namun sel dendritik lebih dominan dan memang telah terspesialisasi untuk menginisiasi respon imun adaptif. Antigen bebas juga bisa menstimulasi reseptor antigen pada sel B, tapi sebagian besar sel B membutuhkan bantuan dari limfosit T helper untuk menghasilkan respon antibodi yang optimal. Aktivasi limfosit T naif adalah langkah awal yang esensial dalam semua respon imun adaptif.

9. Limfosit mengenali dan merespon antigen di organ limfoid perifer
Antigen dan limfosit akan bertemu satu dengan yang lain di organ limfoid sekunder. Limfosit naif matur akan terus bersirkulasi melalui organ ini dan bertemu dengan antigen yang dibawa dari sumber infeksi terutama oleh sel-sel dendritik.
Organ limfoid sekunder ini memiliki kemampuan menjebak sel-sel dendritik pembawa antigen sehingga memungkinkan terjadi inisasi respon imun adaptif. Seperti diketahui, organ limfoid sekunder dipenuhi oleh limfosit-limfosit yang beragregasi dalam jaringan sel-sel nonleukosit stromal yang berfungsi menyokong kebutuhan hidup limfosit itu sendiri. Selain limfosit, organ ini juga ditinggali oleh makrofag dan sel dendritik yang menetap di sana.

Ketika terjadi suatu infeksi di jaringan, antigen bebas dan sel dendritik pembawa antigen akan berpindah dari jaringan tersebut melalui pembuluh limfatik aferen menuju nodus limfe. Di sana, limfosit akan diaktifkan dan mengalami periode proliferasi dan diferensiasi sampai sebagian besar dari mereka akan meninggalkan nodus limfe sebagai sel-sel efektor via pembuluh limfatik eferen. Hal ini otomatis akan membuat mereka kembali beredar di sirkulasi darah yang akan membawa mereka menuju jaringan tempat mereka akan beraksi.
Proses ini memakan waktu selama 4-6 hari sejak antigen pertama kali diperkenalkan, sehingga dengan kata lain respon imun adaptif tidak akan efektif sampai lebih kurang seminggu setelah infeksi. Limfosit naif yang tidak mengenali antigen pun ada juga yang ikut masuk lagi ke pembuluh darah dan kembali lagi ke jaringan limfoid sampai mereka mengenali antigen atau mati.
Kelenjar getah bening adalah organ limfoid yang menjadi titik pertemuan pembuluh-pembuluh dalam sistem limfatik yang membawa cairan ekstraseluler dari jaringan dan mengembalikannya ke pembuluh darah. Cairan ekstraseluler ini diproduksi secara terus menerus melalui penyaringan dari darah dan dikenal dengan nama cairan limfe. Limfe ini akan mengalir dari jaringan perifer akibat tekanan yang terus menerus dihasilkan dari sumber produksinya dan disalurkan melalui pembuluh-pembuluh limfe.
Antigen bebas dari dalam darah dapat berdifusi langsung ke dalam nodus limfe, sementara itu sel-sel dendritik harus aktif masuk ke dalam nodus limfe setelah ditarik oleh kemokin. Kemokin yang sama juga dapat menarik limfosit dari darah dan masuk ke nodus limfe melalui dinding pembuluh darah khusus yang dikenal dengan istilah high endothelial venules (HEV). Sel-sel endotel pada dinding khusus ini lebih tebal dan lebih bundar dibandingkan sel endotel pada umumnya.
Di dalam nodus limfe, limfosit B akan terlokalisasi di folikel, yang membentuk korteks luar dari nodus limfe, sementara limfosit T akan terdistribusi secara difus di sekitar area parakortikal yang disebut juga dengan korteks dalam atau Zona Sel T. Limfosit yang bermigrasi dari darah ke nodus limfe akan terlebih dulu memasuki area parakorteks, dan karena mereka tertarik dengan kemokin, sel-sel dendritik dan makrofag pembawa antigen juga terlokalisasi di sana. Antigen bebas yang berdifusi ke nodus limfe juga akan terjebak di antara sel-sel ini. Adanya antigen, APC, dan sel T naif di dalam zona sel T inilah yang akhirnya membentuk lingkungan ideal bagi sel-sel T naif sehingga dapat berikatan dengan antigen spesifiknya dan menjadi teraktivasi.
Semetara itu, aktivasi sel B biasanya memerlukan tidak hanya antigen yang berikatan di reseptor sel B, tapi juga bantuan dari sel T helper yang teraktivasi (salah satu jenis sel T efektor). Ketika sel T dan sel B teraktivasi, keduanya bergerak dari batas folikel dan zona sel T dan bertemu satu dengan yang lain sehingga sel T helper dapat menjalankan fungsinya pada sel B. Beberapa folikel sel B meliputi germinal center, tempat dimana sel B yang teraktivasi akan mengalami proses proliferasi dan diferensiasi menjadi sel-sel plasma.

Selain nodus limfe, organ limfoid sekunder penting lainnya pada manusia adalah limpa. Ukurannya sebesar tinju, dan terletak di belakang lambung. Limpa tak terkoneksi langsung dengan sistem limfatik, tapi dia mampu mengumpulkan antigen dari darah dan berperan penting dalam respon imun melawan patogen yang ditularkan melalui darah. Limfosit dapat masuk dan keluar dari limpa melalui pembuluh darah. Limpa juga mempu mengumpulkan dan membuang eritrosit yang rusak.
Limpa terdiri dari pulpa merah dan pulpa putih. Pulpa merah merupakan pusat penghancuran eritrosit, sementara pulpa putih dipenuhi oleh arteriol-arteriol yang menggulung dan dilapisi oleh limfosit-limfosit yang disebut periarteolar lymphoid sheath (PALS) dan mengandung banyak sel T. Folikel limfoid juga ada di dekat sana dan dipenuhi oleh sel B. Sebuah area bernama zona marginal mengelilingi folikel tersebut. Tempat ini mengandung sedikit sel T, namun kaya makrofag dan sel B menetap sehingga disebut zona marginal sel B. Mirip dengan yang terjadi di nodus limfe, sel dendritik pembawa antigen yang ada di zona marginal limpa akan bermigrasi ke area sel T untuk menjalankan fungsinya sebagai APC.

10. Permukaan mukosa memiliki struktur imun yang menimbulkan respon pada lingkungan mikroba.
Mukosa merupakan tempat yang paling sering menjadi awal mula masuknya patogen di dalam tubuh. Untuk itu, permukaannya dilindungi oleh struktur jaringan limfe yang dikenal dengan MALT, atau mucosa-associated lymphoid tissues.
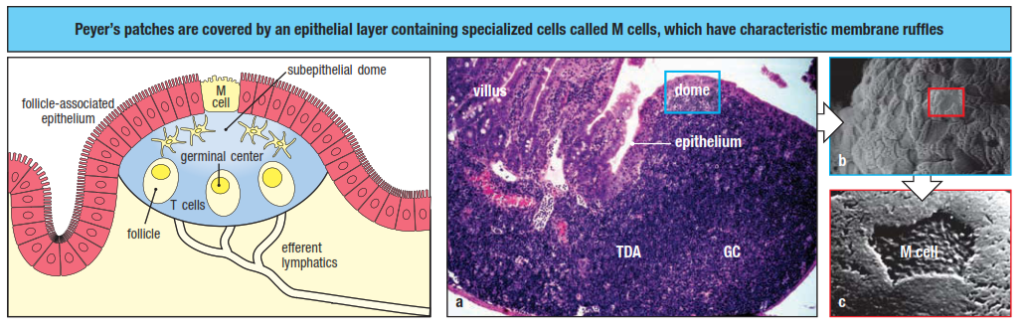
MALT ini dipenuhi oleh banyak sekali limfosit yang peranannya agak berbeda dengan organ limfoid perifer lainnya. Di saluran pencernaan, jaringan ini disebut GALT (gut-associated lymphoid tissues) yang meliputi tonsil, adenoid, apendiks, dan Peyer’s patches di usus halus yang berfungsi menangkap antigen di permukaan epitel traktus gastro intestinal.
Di Peyer’s patces, antigen ditangkap oleh sel-sel epitelial khusus yang disebut microfold atau sel M. Limfosit-limfosit membentuk sebuah folikel yang terdiri dari kubah besar limfosit B dan dikelilingi oleh beberapa limfosit T. Sel-sel dendritik menetap di Peyer’s patch dan mempresentasikan antigen ke limfosit T. Limfosit masuk ke Peyer’s patches dari darah dan keluar melalui limfatik eferen. Limfosit efektor yang diproduksi di Peyer’s patches akan pergi melalui sistem limfatik menuju pembuluh darah, dimana mereka pada akhirnya kembali ke jaringan mukosa untuk melakukan aksi efektornya.
Selain di saluran cerna, MALT juga terdapat di saluran pernapasan sebagai NALT (nasal-associated lymphoid tissue) dan BALT (bronchus-associated lymphoid tissue).
Meskipun bentuknya beda, nodus limfe, limpa dan MALT memiliki arsitektur yang serupa. Pada prinsipnya, mereka menangkap antigen dan APC dari pusat infeksi untuk dipresentasikan ke limfosit kecil yang bermigrasi sehingga mencetuskan respon imun adaptif. Mereka juga bertugas untuk menjaga sinyal-sinyal ke limfosit agar dapat berteu dengan antigen spesifiknya dengan cepat, sehingga mereka dapat bertahan dan lanjut bersirkulasi.
11. Limfosit yang teraktivasi oleh antigen akan berproliferasi di organ limfoid sekunder, lalu berubah menjadi sel efektor dan sel memori
Dalam mengenali antigen spesifiknya pada APC, sebuah limfosit naif akan berhenti bermigrasi, volume nukleus dan sitoplasmanya akan meningkat, dan mRNA baru beserta protein-proteinnya akan disintesis. Dalam beberapa jam, sel ini akan terlihat sama sekali berbeda dan disebut limfoblast.
Sel-sel limfoblast ini dapat menduplikasi diri mereka masing-masing sebanyak 2-4 kali setiap 24 jam selama 3-5 hari, sehingga satu sel limfosit naif tunggal akan mampu memproduksi salinan dirinya hingga 1.000 sel anak yang spesifik dan identik. Mereka semua ini nantinya akan berdiferensiasi menjadi sel-sel efektor.
Bagi sel B, sel efektor ini adalah sel plasma, yang mensekresikan antibodi. Sementara bagi Sel T, sel efektor ini tidak lain adalah sel T sitotoksik, yang mampu menghancurkan sel-sel terinfeksi, atau sel T helper, yang mampu mengaktivasi sel-sel lainnya di dalam sistem imun.
Limfosit efektor tidak beresirkulasi seperti limfosit naif. Beberapa sel T efektor akan mendeteksi pusat-pusat infeksi dan bermigrasi ke sana dari darah, sementara yang lainnya akan menetap di jaringan limfoid untuk mengaktivasi sel B. Beberapa sel-sel plasma yang mensekresikan antibodi akan tetap juga tinggal di organ limfoid sekunder, tapi sebagian besar sel plasma yang terbentuk di nodus limfe dan limpa akan bermigrasi ke sumsum tulang dan menetap di sana sembari mensekresikan antibodi dalam jumlah besar ke sistem peredaran darah. Sel-sel efektor yang terbentuk di sistem imun mukosa juga pada umumnya menetap di jaringan mukosa.
Sebagian besar limfosit yang terbentuk dari ekspansi klonal di dalam sebuah respon imun akan mati perlahan-lahan. Akan tetapi, ada sebagian sel B aktif dan sel T aktif yang tetap bertahan setelah antigen spesifiknya dimusnahkan. Sel-sel ini dikenal dengan sel memori dan membentuk dasar dari ingatan imunologis. Mereka dapat diaktifkan kembali lebih cepat dibandigkan limfosit naif, sehingga memberikan respon yang lebih cepat dan efektif pada pemaparan patogen untuk kedua kalinya dan biasanya menghasilkan imunitas protektif yang bertahan lama.
Sifat-sifat ingatan imunologis dapat dilihat pada seseorang dengan membandingkan respon antibodi pada imunisasi awal atau primer dengan imunisasi booster atau sekunder menggunakan antigen yang sama. Respon antibodi sekunder muncul setelah fase lag yang lebih singkat dan menghasilkan jumlah antibodi yang jauh lebih besar dibandingkan respon primer. Selama respon sekunder, antibodi dapat pula mendapatkan afinitas/ kekuatan ikatan yang lebih tinggi terhadap antigen karena melewati proses yang disebut dengan affinity maturation, yang mana berlangsung di germinal center di folikel sel B. Hal ini dibantu oleh sel T helper, namun reseptor sel T tidak mengalaminya.

Dasar seluler dari ingatan imunologis adalah adanya ekspansi dan diferensiasi klonal dari sel-sel yang memiliki ketertarikan khusus pada antigen tertentu. Proses ini memungkinkannya dilakukan vaksinasi dan mencegah terjadinya reinfeksi patogen yang telah dibasmi sepenuhnya oleh respon imun adaptif.

